指缝宽、时间瘦,转眼间,2020 年已度过将近四分之一。
在过去的日子里, NHL 领域的治疗仍不断在被探索,2020 年,有哪些相关热点研究呢?
小编为您罗列了 3 篇热点研究:侵袭性 NHL 用药导致心血管毒性、利妥昔单抗维持治疗老年 MCL 患者疗效以及 CD 19-CAR-NK 输注治疗 B 细胞淋巴瘤,这就带您一睹为快 !
有备无患 !Meta 分析显示高龄 (≥ 65 岁) 和女性是淋巴瘤患者心血管并发症的高危因素,重在监护 !
对于接受非霍奇金淋巴瘤治疗的患者而言,心血管不良事件尤其是心力衰竭的风险处于较高地位。RCHOP 或 CHOP 方案已经成为侵袭性 NHL 患者的一线标准治疗。但 RCHOP 或 CHOP 方案中的阿霉素和环磷酰胺被报道均与左心室功能不全风险相关。本项研究为系统综述和荟萃分析,旨在评估此方案的心血管毒性,以识别用药过程中心血管并发症的危险因素,提示临床预防。
研究者检索了 PubMed、EMBASE 及 Cochrane Library 数据库中 1984 年 4 月至 2019 年 3 月的数据。包括接受 RCHOP 或 CHOP 方案一线治疗的成人 NHL 患者 (DLBCL、FL、MCL、外周 T 细胞淋巴瘤、NHL 非特指型等) 的临床试验或观察性研究。剔除综述、评注、病例报告、会议摘要、临床前研究和非英语写作的文章等。R-CHOP 或 CHOP 联合其他免疫化疗治疗的研究也被排除 (研究筛选情况见图 1),最终共有 137 项符合条件的研究纳入分析。
研究者进行了单样本 Meta 分析,估计患者总体发生 3-4 级心血管不良事件、心力衰竭、1-2 级心血管不良事件、因整体心力衰竭而停止治疗、心血管死亡的比例。并对 3-4 级心血管不良事件和整体心力衰竭进行了亚组分析, 以确定 RCHOP 或 CHOP 治疗周期数、周期间隔、年龄、性别的影响等。
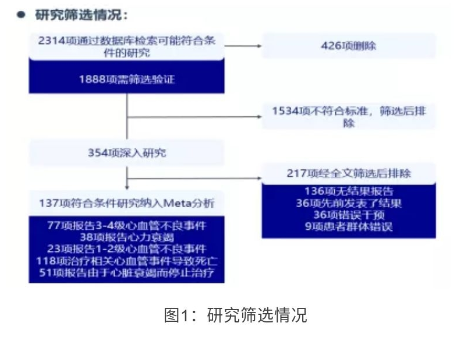
纳入的 137 项研究,共 11293 例患者,85 个亚组 (9541 例) 接受 CHOP 治疗,
76 个亚组 (11293) 例接受 RCHOP 治疗,377 例接受两种方案治疗。纳入研究的中位随访时间为 39.0 个月 (IQR 25.5-52.8) 。
77 项研究 (56%) 的 96 个亚组报告了 3-4 级心血管不良事件 (14351 例) ,纳入 Meta 分析 (异质性检验 Q = 326.21;T²= 0.0042;I = 71.40%;p<0.001),3-4 级心血管不良事件发生率为 0.0%~15.1%, (2.35%,95%CI:1.81-2.93)。
38 项涉及 47 个治疗亚组和 5936 名患者的研究报告了心力衰竭的发生,心力衰竭的发生率为 4.62%(95%CI 2.25 7.65);评估化疗后患者心功能,结果显示心力衰竭发生率从 1.64%(95%CI:0.82-2.65)。上升至 11.72%(95%CI:3.00-24.53)。
亚组分析显示,≥ 65 岁患者 3-4 级心血管不良事件发生风险更高;与男性相比较,女性 3-4 级心血管不良事件发生风险更高。
此项 Meta 分析研究表明,对于采用 RCHOP 或 CHOP 治疗 (接受蒽环类药物化疗) 的侵袭性 NHL 患者而言,识别心血管并发症风险的高危人群至关重要,应在早期即对高危风险患者进行监护,保护心肌功能。
众望所归 ! 老年套细胞淋巴瘤长期随访中,利妥昔单抗维持较 IFN 干扰素显示出生存获益 !
套细胞淋巴瘤 (MCL) 好发于老年患者中,发病的中位年龄为 65 岁,老年患者预后差,治疗时给药剂量不足、药物代谢在体内发生改变以及合并脏器功能异常等都使得老年 MCL 患者的治疗挑战重重。此外,老年患者缓解率低、易复发等问题,使得临床专家不断在探寻老年 MCL 患者治疗及获得长期生存的最佳方式。
随机、开放、Ⅲ期的欧洲 MCL 老年患者试验 (NCT 00209209) 已于 2012 年发表结果证明 R-CHOP 诱导治疗后利妥昔单抗维持治疗可使老年 MCL 患者获益, 此项研究为 NCT 00209209 研究的长期随访, 于近日发表在《JCl in Oncol》上,旨在进一步明确利妥昔单抗维持的长期有效性及安全性。
此项研究纳入了 560 名年龄大于 60 岁的 MCL 患者, 诱导治疗随机分配至 8 周期的 R CHOP 组及 6 周期的 R-FC 组,在诱导治疗结束后,实现完全缓解、不确定的完全缓解及部分缓解的患者,316 名, 再随机分配至利妥昔单抗的单药组及 IFN 干扰素的治疗组进行维持治疗,最后评估诱导治疗及维持治疗的疗效。
该项研究在诱导治疗结束时的应答情况如下表 2 所示
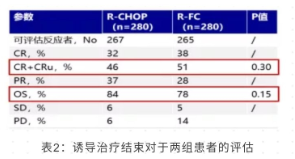
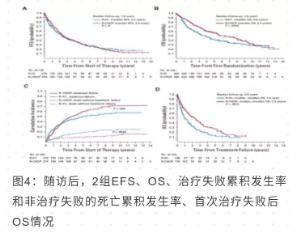
诱导治疗结束后, RCHOP 组与 R-FC 组在 CR 加 CRu 水平及 OS 上的差异并未显示出统计学意义 (表 2)。所有患者平均随访 7.6 年后,中位 FFS, R-CHOP 组, 2.4 年 vs R-FC 组, 2.2 年 (P = 0.9) (图 4A) ; 中位 OS, R-CHOP 组, 6.4 年 vs R-FC 组, 3.9 年,(P = 0.0054) (图 4B) ; 非治疗失败的死亡累积发生率, R-CHOP 组, 9% vsR-FC 组,19%,(P = 0.0043)(图 4C);首次治疗失败后的中位 OS, R-CHOP 组, 2.3 年 vs R-FC 组,1 年 (P = 0.0012)(图 4D)。
截止目前报道,维持治疗的长期随访数据如下表 3 所示
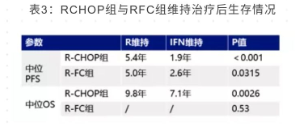
在 R-CHOP 组中, 利妥昔单抗维持较 IFN 维持显示出较优的 PFS 及 OS; 在 R-FC 组中, 利妥昔单抗维持较 IFN 维持显示出较优的 PFS; 在 R-FC 组中, 利妥昔单抗维持与 IFN 维持治疗组虽未有 OS 的差异, 但竞争风险分析显示利妥昔单抗维持对延缓疾病进展有较好的作用。
对 R-CHOP 治疗后利妥昔单抗维持 2 年或 3 年处于缓解的患者进一步进行 PFS 分析发现 (图 5) , 2 年后继续使用利妥昔单抗进行维持的患者 PFS 明显改善 (9.2 年 vs 4.4 年,p = 0.0146),3 年后继续使用利妥昔单抗维持的患者 PFS 明显改善 (9.8 年 vs 4.9 年,P = 0.0028)。
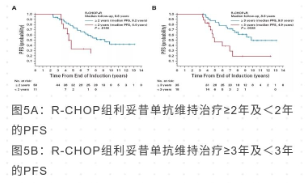
该研究取得了预期的结果, 在老年 MCL 患者中,R-CHOP 诱导和利妥昔单抗维持的良好效果将一直持续。利妥昔单抗维持 2 年以上是安全有效的。
未来可期 !CD 19-CAR-NK 细胞输注治疗可改善 CD19 阳性 B 细胞淋巴瘤患者症状且无严重不良反应。
抗 CD 19 嵌合抗原受体 (CAR) T 细胞疗法治疗 B 细胞肿瘤疗效显著,然而疗效可观的同时伴随着严重的细胞毒副作用。此外, CAR-T 的制备工艺复杂, 不易在体外扩增等因素极大限制了 CAR-T 的临床应用。而自然杀伤 (NK) 细胞经修饰后表达抗 CD19CAR, 有可能克服这些限制。
最近,一项发表在新英格兰杂志上的来自 MD 安德森癌症中心的 I/II 期临床试验 (NCT 03056339) 便报道了 CAR 介导的 NK 细胞在复发难治性 CD 19 阳性 NHL 和 CLL 患者中的作用。该 NK 细胞有一个逆转录病毒载体, 能够表达抗 CD19 CAR、白介素-15(IL-15) 和诱导 caspase 9 作为安全开关的基因。
该项研究纳入了中位年龄 60(47-70) 岁的复发难治性 CD19 阳性 B 细胞淋巴瘤患者 (N = 11 例,5 例高危 CLL, 2 例 DLBCL, 4 例转化型 FL) , 所有 11 例患者均使用了这种人类白细胞抗原 (HLA) 不匹配的脐带血来源的抗 CD19CAR-NK 细胞的输注治疗 (淋巴耗损化疗后以三种剂量 1x105、1x 106、1x107CAR-NK 细胞/kg 之一进行输注),治疗后中位随访 13.8(2.8-20) 个月。
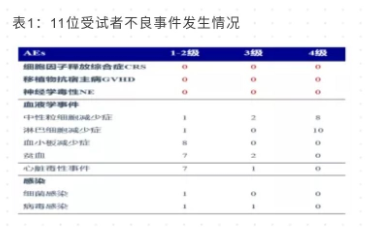
首先,安全性方面 (表 1),该项结果显示输注 CAR-NK 细胞后, 未有患者出现细胞因子释放综合征以及神经毒性反应;尽管受试者接受了脐带血 HLA 不匹配的抗 CD19CAR-NK 细胞输注, 但未有移植物抗宿主病发生。研究人员也并未观察到炎症细胞因子 (包括 IL-6) 的水平升高。
其次,疗效方面 (图 2),11 例患者中 8 例 (73%) 实现了客观缓解,其中完全缓解为 7 人 (64%) 。研究发现一例 Richter's 转化的 CLL 患者 (患者 5) 经 PET-CT 后, 未见氟脱氧葡萄糖摄取病变, 但该患者仍有血细胞减少和 CLL 骨髓浸润,研究者判定该患者达到高级别淋巴瘤缓解。此外,受试者对治疗的反应十分迅速,在治疗后 30 天内全部出现治疗应答, CAR-NK 细胞输注后的扩增和持续表达至少维持 12 个月。
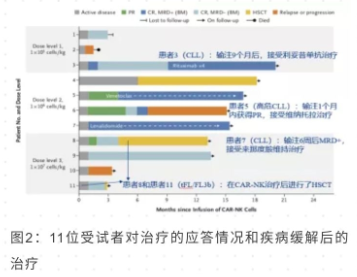
该项研究仍在进一步随访当中,研究初步认为 CAR-NK 细胞治疗可改善 CD 19 阳性 B 细胞淋巴瘤患者症状且无严重不良反应。该癌症中心计划未来将使用 CD19CAR-NK 细胞疗法应用于门诊。
参考资料:
[1] Linschoten M, Kamphuis JAM, van Rhenen A, et al. Cardiovascular adverse events in patients with non-Hodgkin lymphoma treated with first-line cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) or CHOP with rituximab (R-CHOP): a systematic review and meta-analysis. Lancet Haematol. 2020;7(4):e295-e308. doi:10.1016/S2352-3026(20)30031-4
[2] Liu E, Marin D, Banerjee P, et al. Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors. N Engl J Med. 2020;382(6):545-553. doi:10.1056/NEJMoa1910607
[3] Brudno JN, Lam N, Vanasse D, et al. Safety and feasibility of anti-CD19 CAR T cells with fully human binding domains in patients with B-cell lymphoma [published correction appears in Nat Med. 2020 May;26(5):803]. Nat Med. 2020;26(2):270-280. doi:10.1038/s41591-019-0737-3
[4] Kluin-Nelemans HC, Hoster E, Hermine O, et al. Treatment of Older Patients With Mantle Cell Lymphoma (MCL): Long-Term Follow-Up of the Randomized European MCL Elderly Trial. J Clin Oncol. 2020;38(3):248-256. doi:10.1200/JCO.19.01294
